29 ژانویه 2020 / بیمارستان مردمی استان هونان و غیره / داروی اکسیداتیو و طول عمر سلولی
متن/ وو تین یائو
یک مطالعه منتشر شده در "پزشکی اکسیداتیو و طول عمر سلولی" توسط بیمارستان مردمی استان هونان و آزمایشگاه کلیدی اورژانس و مراقبت های ویژه متابونومیک استان هونان اشاره کرد کهگانودرما لوسیدومتری ترپنoids(GLTs)می تواند از سلول های عصبی مغز محافظت کند و از طریق مکانیسم هایی مانند ضد آپوپتوز، ضد اکسیداسیون و گره خوردن های ضد نوروفیبریلاری، از اختلالات شناختی ناشی از بیماری آلزایمر (AD) جلوگیری کند.
گانودرما لوسیدومتری ترپنoidبه تاخیر انداختن زوال شناختی دربیماران بابیماری آلزایمر.
اولین، رمحققین تغذیه کردندگانودرما لوسیدومتری ترپنوئیدها (GLTs) به موش های بیماری آلزایمر (AD) که علائم اولیه را نشان داده بودند. بعد از60 روز، آنهاتواناییهای شناختی موشها را با ماز آبی موریس (MWM) آزمایش کرد.
بهره گیری از ویژگی های موش هایی که به طور طبیعی از آب متنفرند وهمیشهتلاش برای یافتن مکانی برای اجتناب از آب، محققان ماز آبی موریس را انجام دادند، که قرار است یک سکوی استراحت در یک استخر بزرگ دایرهای برای محاسبه مسافت شنای موشها و زمانی که برای یافتن آن صرف میکنند، برپا کنند.استراحت كردنپلت فرم به عنوان شاخصی برای قضاوت در مورد توانایی شناختیiesاز موش هااگر موش ها نتوانستند سکوی استراحت (در عرض دو دقیقه) را پیدا کنند، محققان به راهنمایی کمک خواهند کردeموش ها به سمت سکو.
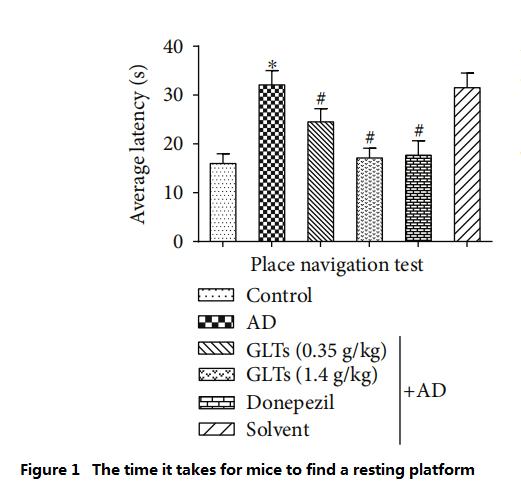
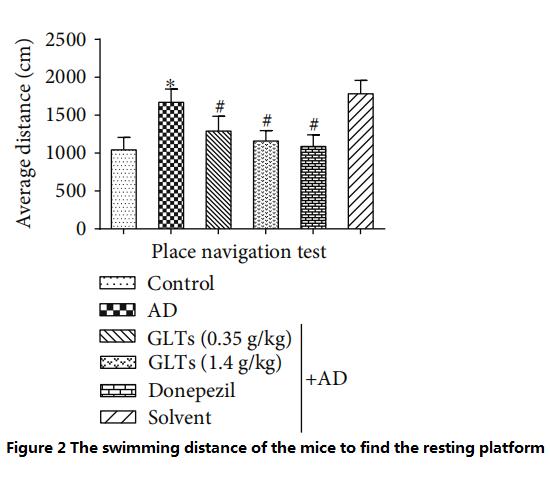
اگرچه نقطه شروع ورود به آب هر بار متفاوت است، موش های معمولی هنوز هم می توانند به سرعت سکوی استراحت را از طریق تجربه روزانه پیدا کنند.چنین آزمایشی یک بار در روز و در مجموع نه روز انجام شد.با محاسبه میانگین تمام امتیازات، محققان دریافتند که موش های AD (AD Group) باید دو برابر بیشتر وقت بگذارند.as یا سه چهارم بیشتر از موشهای معمولی (گروه کنترل) شنا کنید تا یک سکوی استراحت پیدا کنید، که نشان میدهد عملکرد شناختی مغز موشهای AD به میزان قابلتوجهی تحلیل رفته است.
با این حال، موشهای AD که با دوزهای بالا (1.4 گرم بر کیلوگرم در روز) GLT تغذیه میشدند، تقریباً به همان زمان و مسافت شنا را برای یافتن آنها طی کردند.راپلت فرم استراحت به عنوان موش های معمولی و موش های AD (گروه کنترل طب غربی) که هر روز با دونپزیل تغذیه می شوند (شکل 1~2).
(هرچه زمان کمتری نیاز باشد، توانایی شناختی بهتری دارد)
(هرچه فاصله کمتری لازم باشد، توانایی شناختی بهتری دارد)
روز بعد پس از پایان آزمایش فوق، محققان سکوی استراحت استخر را برداشتند و موش ها را به مدت دو دقیقه در آب قرار دادند.
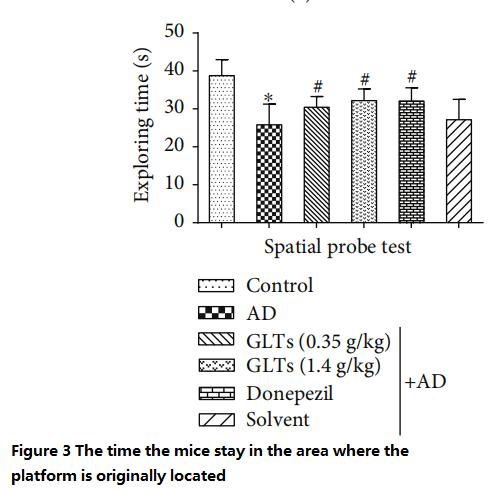
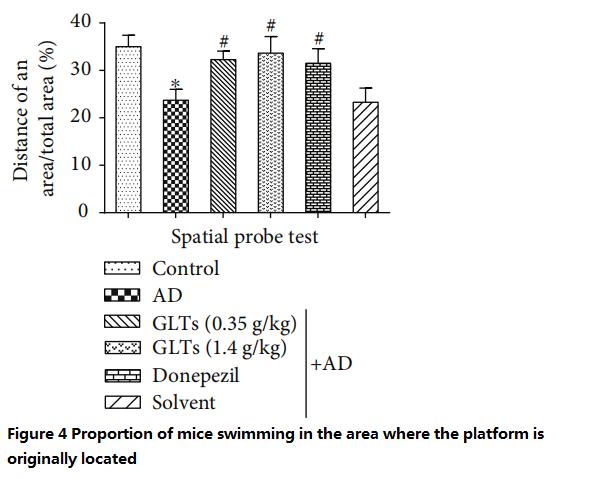
با توجه به تجربه نه روز گذشته، موشهای معمولی مکان اصلی سکو را به خاطر میآورند و زمان بیشتری را صرف شنا کردن در اطراف محل اصلی برای جستجوی «سکوی ناپدید شدن» میکنند در حالی که موشهای آلزایمر بدون هدف شنا میکنند.
در مقابل، موشهای آلزایمر محافظتشده توسط GLT بیشتر شبیه موشهای معمولی رفتار میکردند یا در دوزهای پایین (0.35 گرم بر کیلوگرم در روز) یا دوزهای بالا (1.4 گرم بر کیلوگرم در روز) و تقریباً مشابه موشهای MD تغذیه شده با داروهای غربی بودند. شکل های 3 تا 4).
(هر چه مدت اقامت بیشتر باشد، توانایی شناختی بهتری دارد)
(هرچه این نسبت بیشتر باشد، توانایی شناختی بهتری دارد)
گانودرما لوسیدومتری ترپنoidیکپارچگی سلول های عصبی را حفظ می کند.
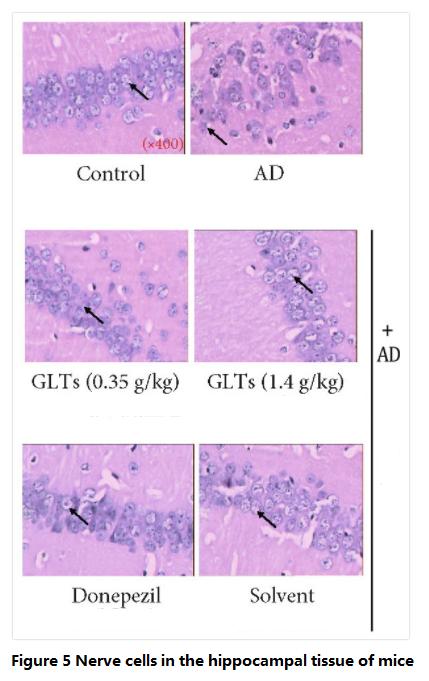
کاهش توانایی یادگیری و حافظه اولین کاهش عملکرد شناختی (اختلال) در بیماران مبتلا به آلزایمر است و سلول های عصبی مسئول این عملکرد در شکنج هیپوکامپ قرار دارند.بنابراین محققان پس از تکمیل آزمایشات فوق، مغز موش را برای بررسی بیشتر تشریح کردند.
نتایج نشان داد که سلولهای عصبی در شکنج هیپوکامپ موشهای نرمال مرتب، اندازه یکنواخت، ظاهری منظم دارند و غشای سلولی و هستههای آنها به وضوح مشخص شدهاند.سلول های عصبی در شکنج هیپوکامپ موش های AD به طور نامنظم، در اندازه های مختلف، ظاهر نامنظم، به شدت کاهش یافته و ساختار آن به وضوح آسیب دیده است.
با این حال، این وضعیت در موش های AD مصرف کننده گانودرما لوسیدوم تری ترپن ظاهر نشدoidسسلولهای عصبی در شکنج هیپوکامپ خود هنوز درجه بالایی از یکپارچگی را حفظ کردهاند و نکروز سلولی آشکاری وجود ندارد، که نشان میدهد کهگانودرما لوسیدومتری ترپنoids یک اثر محافظتی روی شکنج هیپوکامپ داشت (شکل 5).
گانودرما لوسیدومتری ترپنoidرگههای نوروفیبریلاری را کاهش میدهد.
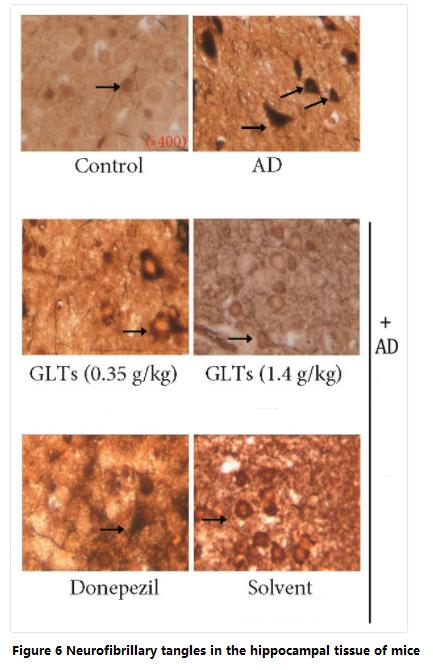
در همان زمان، محققان همچنین دریافتند که تعداد گره های نوروفیبریلاری در قشر مغز (ذخیره حافظه بلند مدت) و بافت شکنج هیپوکامپ در موش های AD محافظت شده توسطگانودرما لوسیدومتری ترپنoids به طور قابل توجهی کمتر از موش های AD درمان نشده بود (شکل 6).
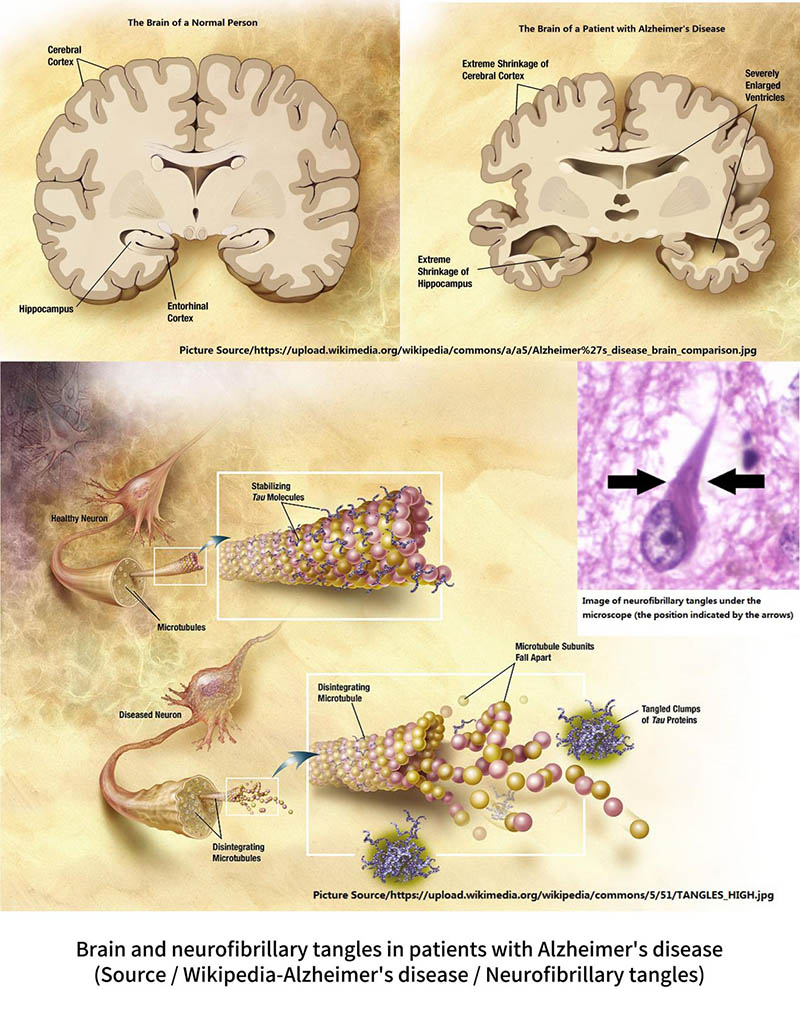
گره خوردن نوروفیبریلاری یکی از علائم اصلی بیماری آلزایمر است.بر خلاف رسوبات آمیلوئیدی که در خارج از سلول ها رخ می دهد، درهم تنیدگی های عصبی فیبریلاری در سلول های عصبی به دلیل جهش "پروتئین تاو" رخ می دهد.
در شرایط عادی، پروتئین تاو به اسکلت سلولی (ریز لوله ها) متصل می شود تا به شکل گیری و پایداری اسکلت سلولی کمک کند.با این حال، پروتئین تاو در مغز بیماران مبتلا به آلزایمر جهش می یابد و نمی تواند به اسکلت سلولی متصل شود.در نتیجه، پروتئین تاو در خوشههایی جمع میشود و به اصطلاح «درهمتنیدگیهای عصبی فیبریلاری» را تشکیل میدهد که در سلولها تجمع میکنند و در عملکرد سلولها اختلال ایجاد میکنند.اسکلت سلولی فاقد پروتئین تائو به تدریج منحرف و متلاشی می شود و منجر به مرگ سلولی می شود.
تعداد گره های نوروفیبریلاری نشان دهنده میزان وخامت بیماری آلزایمر است.بنابراین، تری ترپنوئیدهای گانودرما لوسیدوم می توانند از تشکیل گره های عصبی فیبریلاری جلوگیری کنند که باید یکی از مکانیسم های مهم برایگانودرما لوسیدومتری ترپنوئیدها برای به تاخیر انداختن زوال شناختی در بیماری آلزایمر.
گانودرما لوسیدومتری ترپنoidکاهش آپوپتوز سلول های عصبی
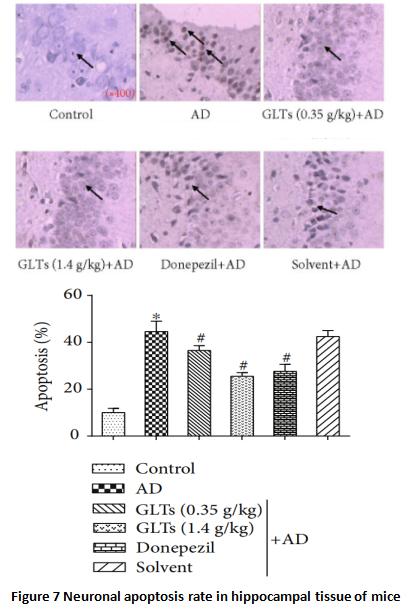
هر دورسوب بتا آمیلوئید یا پیچیدگی های نوروفیبریلاری برنامه خودکشی سلول را آغاز می کند و آپوپتوز سلول های عصبی را ترویج می کند.با مرگ سلولهای عصبی بیشتر، عملکردهای بیشتری از دست میرود و عملکرد شناختیclineناشی از بیماری آلزایمر شدیدتر می شود.
از تجزیه و تحلیل بافت شکنج هیپوکامپ هر گروه از موشهای آزمایشی، میتوان دریافت که میزان مرگ سلولهای عصبی در موشهای AD بیش از چهار برابر موشهای معمولی همسن است.اگرچه با دوز بالاگانودرمالوسیدومتری ترپنoids نمی تواند به طور کاملpجلوگیری از آپوپتوز غیر طبیعی سلول های عصبی،آنهادر هکتارveتوانسته آسیب را به نصف کاهش دهد و تأثیر آن با طب غربی قابل مقایسه است (شکل 7).
محققان بیشتر تجزیه و تحلیل کردند و دریافتند که در موش های AD نگهداری شده توسطگانودرما لوسیدومتری ترپنوئیدها، سلول های عصبی مغز یک مکانیسم آنتی اکسیدانی قوی برای مبارزه با آسیب اکسیداتیو ناشی از پروتئین β-آمیلوئید دارند و مکانیسم آپوپتوز سلولی به راحتی فعال نمی شود.به عبارت دیگر، تری ترپنهای گانودرما لوسیدوم مقاومت سلولهای عصبی مغز را در برابر استرس تقویت میکنند و باعث میشوند که آنها بتوانند در محیطهای سخت زنده بمانند و عمل کنند.
گانودرما لوسیدومپلی ساکاریدها نیز مفید هستند.
نتایج تحقیقات فوق نشان می دهد کهگانودرما لوسیدومتری ترپنوئیدها، پس از ورود به دستگاه گوارش از طریق مری، می توانند پیشرفت بیماری آلزایمر را از طریق ضد اکسیداسیون، ضد آپوپتوز و گره خوردگی های ضد نوروفیبریلار کاهش دهند.
در واقع اثر ازگانودرما لوسیدومپلی ساکارید نیستضعیف ترنسبت به گانودرما لوسیدوم تری ترپنoidسدر سال 2017، مطالعه ای که به طور مشترک در "گزارش های سلول های بنیادی" توسط دانشگاه تونجی و آکادمی علوم چین منتشر شد، ثابت کرد که نگهداری طولانی مدت باگانودرما لوسیدومعصاره آب یاگانودرما لوسیدومپلی ساکاریدها می توانند رسوبات بتا آمیلوئید را در مغز موش های AD کاهش دهند، به تکثیر سلول های پیش ساز عصبی در شکنج هیپوکامپ کمک کرده و کاهش یادگیری و حافظه را کاهش دهند.(برای جزئیات، نگاه کنید به:پلی ساکارید گانودرما لوسیدومsکاهش زوال شناختی ناشی از بیماری آلزایمر)
گانودرما لوسیدومتری ترپنوئیدها وگانودرما لوسیدومبه نظر می رسد پلی ساکاریدها اثرات متفاوتی در محافظت از مغز در برابر بیماری آلزایمر دارند.می تواناثر ترکیبی این دو باعث کاهش پیشرفت بیماری آلزایمر می شود?
هنگامی که بیماری آلزایمر رخ می دهد، معکوس کردن آن دشوار است.با این حال، اگرweمی تواند توانایی های شناختی بیشتری از جمله یادگیری و حافظه را در خود حفظ کندمازندگی محدود،weممکن است شانس بهبودی با بیماری آلزایمر را داشته باشد.
منبع
1. یو ن، و همکاران.گانودرما لوسیدومتری ترپنوئیدها (GLTs) آپوپتوز عصبی را از طریق مهار مسیر سیگنال ROCK در موش های تراریخته مبتلا به آلزایمر APP/PS1 کاهش می دهند.Oxid Med Cell Longev.2020;2020: 9894037.
2. هوانگ اس، و همکاران.پلی ساکاریدها ازگانودرما لوسیدومترویج عملکرد شناختی و تکثیر پیش ساز عصبی در مدل موش بیماری آلزایمر.گزارش های سلول های بنیادی2017 ژانویه 10; 8 (1): 84-94.doi: 10.1016/j.stemcr.2016.12.007.
پایان
درباره نویسنده/ خانم وو تینگیائو
وو تین یائو از دست اول گزارش داده استگانودرما لوسیدوماطلاعات از سال 1999. او نویسنده استدرمان با گانودرما(منتشر شده در The People's Medical Publishing House در آوریل 2017).
★ این مقاله با مجوز انحصاری نویسنده منتشر شده است ★ آثار فوق بدون مجوز نویسنده قابل تکثیر، گزیده یا استفاده به روش های دیگر نمی باشد ★ تخلف از بیانیه فوق، نویسنده مسئولیت های قانونی مربوط به خود را دنبال خواهد کرد. متن این مقاله توسط وو تینگیائو به زبان چینی نوشته شده و توسط آلفرد لیو به انگلیسی ترجمه شده است.اگر بین ترجمه (انگلیسی) و اصل (چینی) مغایرت وجود داشته باشد، اصل چینی ارجحیت دارد.اگر خوانندگان سؤالی دارند، لطفاً با نویسنده اصلی، خانم وو تینگیائو تماس بگیرید.
زمان ارسال: آگوست-04-2021