29 يناير 2020 / مستشفى الشعب بمقاطعة هونان، وما إلى ذلك / الطب التأكسدي وطول العمر الخلوي
نص / وو تينغياو
أشارت دراسة نشرت في "الطب التأكسدي وطول العمر الخلوي" من قبل مستشفى الشعب في مقاطعة هونان والمختبر الرئيسي لمقاطعة هونان لحالات الطوارئ والرعاية الحرجة الاستقلابية إلى أنغانوديرما لوكيدومترايتيربينمعرف com لهذا التطبيق هو com.oids(خطوط طيران الخليج)يمكن أن يحمي الخلايا العصبية في الدماغ ويقلل من الضعف الإدراكي الناجم عن مرض الزهايمر (AD) من خلال آليات مثل مكافحة موت الخلايا المبرمج، ومضادات الأكسدة، والتشابك المضاد للليف العصبي.
غانوديرما لوكيدومترايتيربينمعرف com لهذا التطبيق هو com.oidتأخير التدهور المعرفي فيالمرضى الذين يعانونمرض الزهايمر.
أولاً، صتغذية الباحثينغانوديرما لوكيدومترايتيربينويدس (GLTs) إلى الفئران المصابة بمرض الزهايمر (AD) والتي ظهرت عليها أعراض مبكرة. بعد60 يوما، همتم اختبار القدرات المعرفية للفئران باستخدام متاهة موريس المائية (MWM).
الاستفادة من خصائص الفئران التي تكره الماء بطبيعتها ودائماًحاول العثور على مكان لتجنب الماء، أجرى الباحثون متاهة موريس المائية، وهي عبارة عن إقامة منصة استراحة في بركة دائرية كبيرة لحساب المسافة التي تسبحها الفئران والوقت الذي تقضيه في العثور على المكان.يستريحمنصة كفهارس للحكم على القدرة المعرفيةiesمن الفئران.إذا لم تتمكن الفئران من العثور على منصة الراحة (خلال دقيقتين)، فسيساعدها الباحثون في التوجيهeالفئران إلى المنصة.
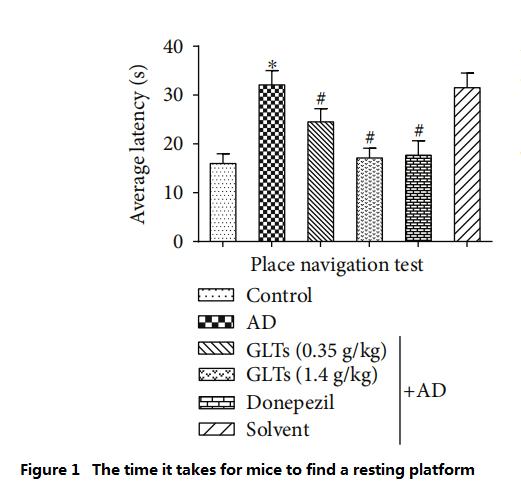
على الرغم من أن نقطة البداية لدخول الماء تختلف في كل مرة، إلا أن الفئران العادية لا تزال قادرة على العثور بسرعة على منصة الراحة من خلال التجربة اليومية.تم إجراء مثل هذه التجربة مرة واحدة يوميًا لمدة تسعة أيام.وبحساب جميع الدرجات في المتوسط، وجد الباحثون أن الفئران AD (المجموعة AD) يجب أن تقضي ضعف المدةas أو السباحة لفترة أطول بثلاثة أرباع من الفئران العادية (المجموعة الضابطة) للعثور على منصة للراحة، مما يشير إلى أن الوظيفة الإدراكية لدماغ الفئران المصابة بمرض الزهايمر قد تدهورت بشكل كبير.
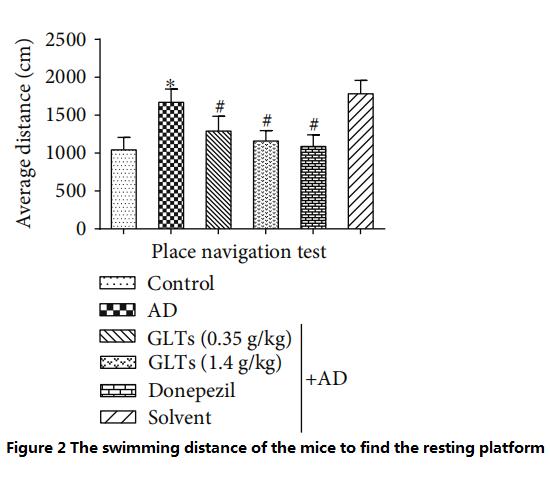
ومع ذلك، فإن الفئران التي تم تغذيتها بجرعات عالية (1.4 جم/كجم يوميًا) من GLTs استغرقت تقريبًا نفس الوقت ومسافة السباحة للعثور على هذه الخلايا.المنصة الراحة مثل الفئران العادية والفئران AD (مجموعة مراقبة الطب الغربي) التي تتغذى على دونيبيزيل كل يوم (الشكل 1 ~ 2).
(كلما قل الوقت المطلوب، كلما كانت القدرة المعرفية أفضل)
(كلما كانت المسافة المطلوبة أقل، كانت القدرة المعرفية أفضل)
في اليوم التالي بعد انتهاء التجربة المذكورة أعلاه، أزال الباحثون منصة الاستراحة في حوض السباحة ووضعوا الفئران في الماء لمدة دقيقتين.
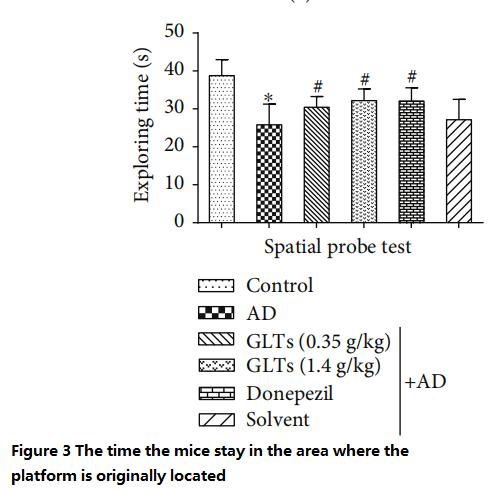
ونظرًا للأيام التسعة السابقة من الخبرة، تذكرت الفئران العادية الموقع الأصلي للمنصة وأمضت وقتًا أطول في السباحة حول الموقع الأصلي للبحث عن "المنصة المختفية"، بينما سبحت الفئران المصابة بمرض الزهايمر بلا هدف.
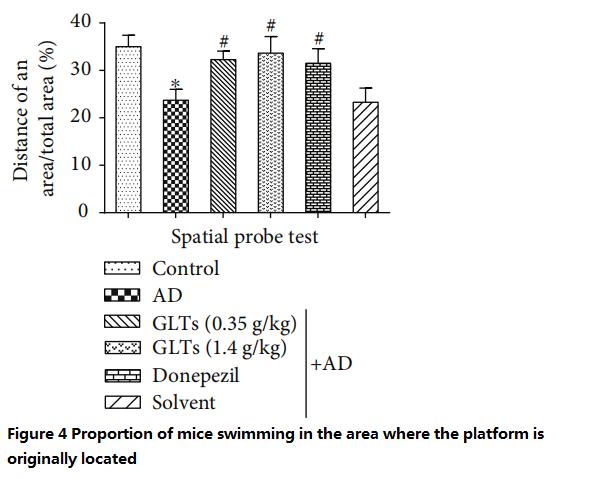
في المقابل، تصرفت الفئران المصابة بالزهايمر المحمية بواسطة GLTs مثل الفئران العادية إما بجرعات منخفضة (0.35 جم / كجم يوميًا) أو بجرعات عالية (1.4 جم / كجم يوميًا) وسجلت تقريبًا نفس النتائج التي سجلتها الفئران المصابة بالمرض التي تم تغذيتها بالطب الغربي ( الأشكال من 3 إلى 4).
(كلما طالت فترة الإقامة، كانت القدرة المعرفية أفضل)
(كلما زادت النسبة كلما كانت القدرة المعرفية أفضل)
غانوديرما لوكيدومترايتيربينمعرف com لهذا التطبيق هو com.oidالحفاظ على سلامة الخلايا العصبية.
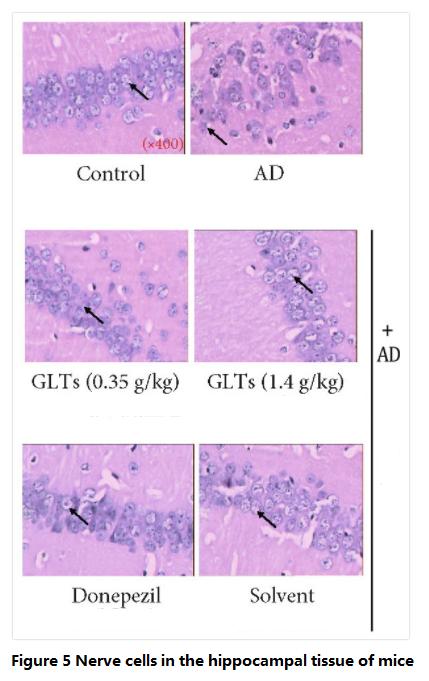
انخفاض القدرة على التعلم والذاكرة هو أول تراجع (اضطراب) في الوظيفة الإدراكية لدى مرضى الزهايمر، وتقع الخلايا العصبية المسؤولة عن هذه الوظيفة في التلفيف الحصين.لذلك، بعد أن أكمل الباحثون التجارب المذكورة أعلاه، قاموا بتشريح دماغ الفأر لمزيد من الفحص.
أظهرت النتائج أن الخلايا العصبية في التلفيف الحصيني لدى الفئران العادية مرتبة بشكل أنيق، وموحدة في الحجم، ومنتظمة في المظهر، كما أن أغشية الخلايا ونواتها محددة بوضوح؛الخلايا العصبية في التلفيف الحصين لدى الفئران AD مرتبة بشكل غير منتظم، ومختلفة في الأحجام، وغير منتظمة في المظهر، وانخفاض عددها بشكل كبير، ومن الواضح أن بنيتها تالفة.
ومع ذلك، فإن هذا الوضع لم يظهر في الفئران التي تستهلك غانوديرما لوكيدوم ترايتيربينمعرف com لهذا التطبيق هو com.oidس.لا تزال الخلايا العصبية الموجودة في التلفيف الحصيني تحافظ على درجة عالية من السلامة، ولم يكن هناك نخر واضح للخلايا، مما يشير إلى ذلكغانوديرما لوكيدومترايتيربينمعرف com لهذا التطبيق هو com.oidكان له تأثير وقائي على التلفيف الحصين (الشكل 5).
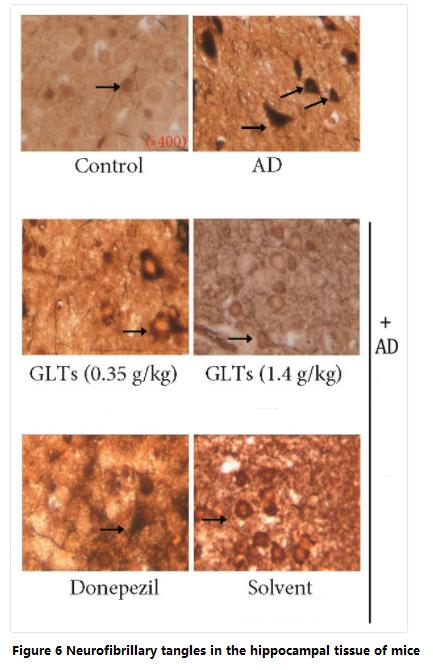
غانوديرما لوكيدومترايتيربينمعرف com لهذا التطبيق هو com.oidيقلل من التشابك الليفي العصبي.
وفي الوقت نفسه، وجد الباحثون أيضًا أن عدد التشابكات الليفية العصبية في القشرة الدماغية (تخزين الذاكرة طويلة المدى) وأنسجة التلفيف الحصين في الفئران المصابة بمرض الزهايمر محمية بواسطةغانوديرما لوكيدومترايتيربينمعرف com لهذا التطبيق هو com.oidكان s أقل بكثير من ذلك في الفئران م غير المعالجة (الشكل 6).
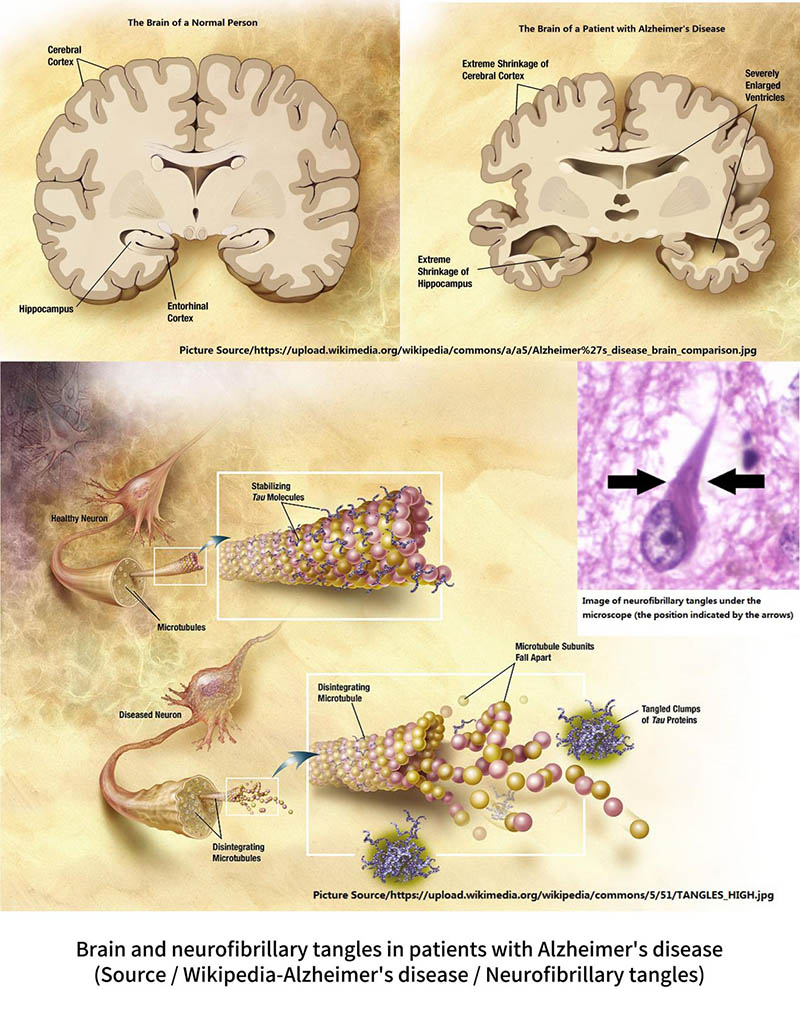
التشابكات الليفية العصبية هي أحد الأعراض الرئيسية لمرض الزهايمر.على عكس رواسب الأميلويد التي تحدث خارج الخلايا، تحدث التشابكات الليفية العصبية في الخلايا العصبية بسبب طفرة "بروتين تاو".
في الظروف العادية، يرتبط بروتين تاو بالهيكل الخلوي (الأنابيب الدقيقة) للمساعدة في تكوين واستقرار الهيكل الخلوي.ومع ذلك، فإن بروتين تاو الموجود في دماغ مرضى الزهايمر سوف يتحور ولا يمكنه الارتباط بالهيكل الخلوي.ونتيجة لذلك، يتجمع بروتين تاو في مجموعات لتشكل ما يسمى "التشابك الليفي العصبي"، والتي تتراكم في الخلايا وتتداخل مع وظيفة الخلايا.سوف يصبح الهيكل الخلوي الذي يفتقر إلى بروتين تاو مشوهًا ويتفكك تدريجيًا، مما يؤدي إلى موت الخلايا.
ويعكس عدد التشابكات الليفية العصبية درجة تدهور مرض الزهايمر.ولذلك، فإن ترايتيربينويدات غانوديرما لوكيدوم يمكن أن تمنع تكوين التشابكات الليفية العصبية، والتي ينبغي أن تكون إحدى الآليات المهمة لتكوين التشابكات الليفية العصبية.غانوديرما لوكيدومترايتيربينويدس لتأخير التدهور المعرفي في مرض الزهايمر.
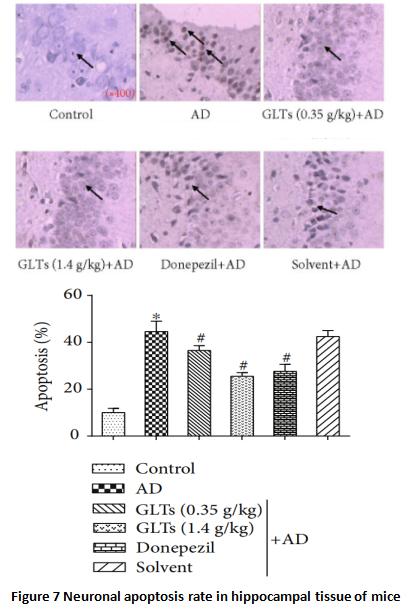
غانوديرما لوكيدومترايتيربينمعرف com لهذا التطبيق هو com.oidتقليل موت الخلايا المبرمج للخلايا العصبية.
أيضاًسوف يؤدي ترسب الأميلويد بيتا أو التشابك الليفي العصبي إلى بدء البرنامج الانتحاري للخلية وتعزيز موت الخلايا المبرمج للخلايا العصبية.ومع موت المزيد من الخلايا العصبية، يتم فقدان المزيد من الوظائف، ويضعف الإدراك المعرفيكلاينالناجم عن مرض الزهايمر يصبح أكثر خطورة.
ومن تحليل أنسجة التلفيف الحصين لكل مجموعة من الفئران التجريبية، يمكن العثور على أن معدل موت الخلايا العصبية في الفئران المصابة بمرض الزهايمر يزيد عن أربعة أضعاف معدل موت الخلايا العصبية في الفئران العادية من نفس العمر؛على الرغم من جرعة عاليةالجانوديرماواضحترايتيربينمعرف com لهذا التطبيق هو com.oidلا يمكن تماماpمنع موت الخلايا المبرمج غير الطبيعي للخلايا العصبية ،همهكتارveتمكنت من خفض الضرر إلى النصف، وكان التأثير مشابهًا لتأثير الطب الغربي (الشكل 7).
وقام الباحثون بتحليل كذلك ووجدوا أنه في الفئران م التي تحتفظ بهاغانوديرما لوكيدومtriterpenoids، تمتلك الخلايا العصبية في الدماغ آلية قوية مضادة للأكسدة لمكافحة الضرر التأكسدي الناجم عن بروتين β-amyloid ولا يتم تنشيط آلية موت الخلايا المبرمج بسهولة.وبعبارة أخرى، فإن تريتربين غانوديرما لوكيدوم يعزز مقاومة الإجهاد للخلايا العصبية في الدماغ، مما يجعلها أكثر قدرة على البقاء والعمل في بيئة قاسية.
غانوديرما لوكيدومالسكريات مفيدة أيضًا.
وتظهر نتائج البحوث المذكورة أعلاه ذلكغانوديرما لوكيدوميمكن للترايتيربينويدات، بعد دخولها إلى الجهاز الهضمي عبر المريء، أن تبطئ تطور مرض الزهايمر من خلال مضادات الأكسدة، ومضادات موت الخلايا المبرمج، والتشابكات الليفية العصبية.
في الواقع، تأثيرغانوديرما لوكيدومالسكريات ليست كذلكأضعفمن أن غانوديرما لوكيدوم ترايتيربينمعرف com لهذا التطبيق هو com.oidس.في عام 2017، أثبتت دراسة مشتركة في "تقارير الخلايا الجذعية" من قبل جامعة تونغجي والأكاديمية الصينية للعلوم أن الصيانة طويلة الأمد معغانوديرما لوكيدوممستخلص الماء أوغانوديرما لوكيدوميمكن أن تقلل السكريات من رواسب بيتا أميلويد في أدمغة الفئران المصابة بمرض الزهايمر، وتساعد على تكاثر الخلايا السليفة العصبية في التلفيف الحصين وتبطئ تراجع التعلم والذاكرة.(للحصول على التفاصيل، راجع:غانوديرما لوكيدوم عديد السكاريدsالحد من التدهور المعرفي الناجم عن مرض الزهايمر)
غانوديرما لوكيدومترايتيربينويدس وغانوديرما لوكيدوميبدو أن السكريات لها تأثيرات مختلفة في حماية الدماغ من مرض الزهايمر.يستطيعالتأثير المشترك للاثنين يبطئ تطور مرض الزهايمر?
بمجرد ظهور مرض الزهايمر، يكون من الصعب عكسه.ومع ذلك، إذاweيمكنه الاحتفاظ بمزيد من القدرات المعرفية، بما في ذلك التعلم والذاكرةملكناحياة محدودة،weقد يكون لديه فرصة للتحسن مع مرض الزهايمر.
مصدر
1. يو ن، وآخرون.غانوديرما لوكيدومTriterpenoids (GLTs) تقلل من موت الخلايا المبرمج للخلايا العصبية عن طريق تثبيط مسار إشارة ROCK في فئران مرض الزهايمر المعدلة وراثيا APP / PS1.أكسيد ميد خلية لونجيف.2020;2020: 9894037.
2. هوانغ س، وآخرون.السكريات منغانوديرما لوكيدومتعزيز الوظيفة الإدراكية وانتشار السلف العصبي في نموذج الفأر لمرض الزهايمر.تقارير الخلايا الجذعية.2017 يناير 10;8(1):84-94.دوى: 10.1016/j.stemcr.2016.12.007.
نهاية
نبذة عن الكاتب/ السيدة وو تينغياو
قام وو تينغ ياو بتقديم تقارير مباشرةغانوديرما لوكيدومالمعلومات منذ عام 1999. وهي مؤلفةالشفاء بالجانوديرما(نُشر في دار النشر الطبية الشعبية في أبريل 2017).
★ تم نشر هذه المقالة بموجب إذن حصري من المؤلف ★ لا يمكن إعادة إنتاج الأعمال المذكورة أعلاه أو اقتباسها أو استخدامها بطرق أخرى دون إذن المؤلف ★ انتهاك البيان أعلاه، سيواصل المؤلف مسؤولياته القانونية ذات الصلة ★ الأصل تمت كتابة نص هذه المقالة باللغة الصينية بواسطة وو تينغياو وترجمها إلى الإنجليزية ألفريد ليو.إذا كان هناك أي تعارض بين الترجمة (الإنجليزية) والأصل (الصيني)، فإن اللغة الصينية الأصلية هي التي تسود.إذا كان لدى القراء أي أسئلة، يرجى الاتصال بالمؤلف الأصلي، السيدة وو تينغياو.
وقت النشر: 04 أغسطس 2021